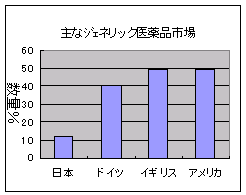
 現在、日本の後発品市場は、薬価ベースで5%、数量ベース10%程度と言われ、ドイツ、アメリカ、イギリスの数量ベース50%と比べても大きく立ち遅れています。
現在、日本の後発品市場は、薬価ベースで5%、数量ベース10%程度と言われ、ドイツ、アメリカ、イギリスの数量ベース50%と比べても大きく立ち遅れています。2002年10月24日
東京民連医連東京薬剤委員会
先の国会で可決された医療改悪法案などの社会保障費用の国民への負担増は3兆円にのぼるといわれます。中でも医療改悪による国民の負担増は、受療権を奪い、ひいては命すらも奪うような深刻な事態が進んでいます。
政府自民党は、医療改悪を行う最大の理由として、医療財源問題をあげていますが、実際の財源を患者負担に求めるのみで、この深刻な不況の中で利益率20%という製薬メーカーの特異なぼろもうけには全く手をつけようとしません。
現在の日本の医薬品行政のゆがみは、度重なる新薬による副作用被害を見ても、新薬偏重、ひいては大手製薬企業優遇の医薬品行政に最大の原因があるといって過言でありません。
一方、後発品は薬価が先発品の4割〜8割の薬価とされ、患者の医薬品費負担の軽減が期待できます。また、その有効性と安全性について試されずみの薬品も多く存在します。東京民医連としても、これらの使用促進策について検討をしてゆかなくてはなりません。
医療用医薬品には、同じ成分でも、日本で最初に発売された薬(新薬)は先発品と呼ばれ、新薬の特許が切れた後に厚生労働省の承認を得て発売される薬を後発品と呼びます。新薬は、特許を出願してから20〜25年間、開発メーカーが独占的に製造販売しています。
後発品は欧米では一般名(generic name)(※成分名のこと)で処方されることが多いためジェネリック医薬品とも呼ばれています。
後発品は、新薬の特許期間が満了するまでには、発売されてから長期間を経ていますので、その期間中の多くの使用実績や安全性の定期報告等により、その薬は発売されてまもない新薬と比べて効き目や安全性が確認されたものが多いといえます。
後発品には「安かろう、悪かろう」のイメージがつきまとっています。これは主として日本の厚生労働省が後発品に関して行ってきた品質保証にたいする施策が諸外国に比べ非常に遅かったことが上げられます。
欧米ではアメリカのオレンジブック(FDAがジェネリック品に対し品質の調査を行いリスト化したもの)象徴されるように1980年代初頭からジェネリック薬品の品質保証に取り組んできました。(現在、日本版オレンジブックの作業が今年度完了する予定ですが、欧米から20年以上遅れをとりました。)
また、日本では1978年の薬価改定で先発メーカーの要請に答え、それまでの一般名収載を銘柄別収載(商品名での収載)に転換しており、後発品の使用促進という意味では時代を逆行した政策をとってきました。
先の日本版オレンジブックの完了や1995年から始まった新規後発品申請要件での、生物学的同等性試験のより厳正化、新GMP実施により、後発品製造ラインの品質保持、lot間同等性が近年より進みました。
このような状況は後発品の品質に対して国として保障する施策の基礎が出来、後発品を使用するための大切な条件がそろったといえます。
 現在、日本の後発品市場は、薬価ベースで5%、数量ベース10%程度と言われ、ドイツ、アメリカ、イギリスの数量ベース50%と比べても大きく立ち遅れています。
現在、日本の後発品市場は、薬価ベースで5%、数量ベース10%程度と言われ、ドイツ、アメリカ、イギリスの数量ベース50%と比べても大きく立ち遅れています。
これらは、米国などで認められている代替調剤(医師の処方薬の銘柄選定は患者の確認のもと薬局、薬剤師が行える制度)が認められていないこと、薬価を銘柄別収載にしたことで、変更が煩雑になったこと、先にもあげた品質保証に対する国の対応が遅かったことなどがあげられます。
日本の医療費にしめる医薬品費の割合は約25%と欧米の10数%に比べても2倍以上の比率をしめています。この総額6兆円の医薬品費の中の1/3の2兆円がローカルドラッグ(日本でのみ使用されている海外で評価されていない薬剤)、後発品のある先発が同じく2兆円といわれます。
日本で欧米並みに後発品使用を行うと約2兆円の薬品費が軽減されるとされています。
日本の厚生労働省は、後発使用促進策として、2002年度の薬価、診療報酬改定では、後発品使用促進のための調剤報酬上の改定が行われました。後発品銘柄を使用した場合、剤ごとに20円、一般名処方の処方箋を受けた調剤薬局が患者に後発品理解の文書等を提供、同意のもと調剤を行うと100円の技術量が算定できるようになりました。
今年6月には、厚生労働省は、全国国立病院に後発品の積極的使用させるための異例の通達を出しています。しかし、厚生労働委員会の共産党児玉議員の質疑でも明らかになったように、今年度の国立病院の後発品使用実態の調査では金額ベースで0.6%、品目ベースでも3%となっています。
日本の後発品使用は、欧米に比べれば大きな差がある現状は、大きな変化がありません。
安いくすり代を求めて、後発品の使用を望む患者がいても、現実には後発品を使っている病院が見当たらないという現状が存在しています。
現在東京民医連の後発品使用の現状は薬価ベースで15%、(購入価ベース11%)品目ベースでは17%という現状です。
現在、東京民医連で推奨銘柄などとなって購入実績がある後発品に全ての院所が変更を行うと、全薬価ベースで一割の減額となります。従って、患者の医薬品負担が同1割減るということとなります。
薬価差益は価格交渉途中ですが後発品は先発と比べ薬価そのものが低く、先発を選んだ差益と同等程度が予想されますが、多くの差益確保を考えるのはむつかしくなってきています。
療養型病床の定額制への対応として薬品費を引き下げるにも大変有効であり、また、東京の全体の医薬品費で月当たりおおよそ9500万の薬品費減少が見込まれ、法人経営の資金問題としても有効です。
| 85年 | カタゲン ナウゼリン注射液 |
| 87年 | ソルベン(発がん性問題) |
| 89年 | ホパテ(実質上の販売中止) |
| 90年 | ジレバロール |
| 91年 | MMRワクチン |
| 93年 | ソリブジン |
| 97年 | ノスカール |
| 99年 | リサモール |
「患者にとって安全で有効な薬品とはなにか」について考える時に、一世を風靡した、脳代謝改善剤が医薬品市場から消えたことや、鳴り物入りの画期的新薬、ノスカールが副作用死を数多く出し販売中止になったことは教訓的です。メーカーが様々な開発費、宣伝費を振りまくのは新薬であり、高価で差益も大きく医療機関も使いたがるという薬害を引き起こす構造的な問題が社会的にも指摘されてきました。
しかし、2002年度の薬価改定では、画期的新薬(ピカ新)の薬価は、同じ効果を持つ対象薬品の2倍の薬価(類似薬効比較方式)が付けられることとなりました。(2000年の改定では1.4倍までとしていた)。
新薬偏重の薬品行政は、改善されるどころかさらに加速しているのが現状です。
日本では毎年30成分以上の新薬が承認されていますが、有用な新薬と呼べるものは極めて少数です。
一方で、WHOが「世界の標準薬」として定めた「エッセンシャル・ドラッグリスト」に収載されている医薬品で、日本で使用されていないものが多くあります。
埼玉民医連でも県連でのエッセンシャルドラッグの選出が取り組まれています。
東京民医連でもクリニカルパスの実践や、定額制に向けた薬物療法の見直し、EBM(Evidence‐Based Medicine・根拠に基づく医療実践)の手法を取り入れながら患者負担を減らし、より安全で有効な薬物療法を追求するために、さらにより良い後発品を十分採用した民医連版エッセンシャルドラッグづくりを進めていくことが重要です。
この間、国会質疑で後発品使用についてとりあげられ、厚生労働省も重い腰をあげ国立病院で、後発品使用促進策が行われています。
保険医協会でも積極的な後発品使用の運動を繰り広げています。
しかし、その普及はいまだ十分でなく東京民医連としても都立病院をはじめ、近隣の医療機関にも後発品の使用促進をはかるための積極的な働きかけの運動、また代替調剤などの制度化を厚生労働省に求める運動を行って行く必要があります。
最後に、この国民の医療に対して稀有の攻撃がかけられている中で薬剤委員会は各法人院所に以下のことを提起したいと思います。
院所法人での使用薬品名柄の中で後発品の存在する医薬品について医師協と協議のもと後発品使用を検討すること
各専門医師グループ、法人薬事委員会で東京民医連版、院所版エッセンシャルドラッグの選出する取り組みに着手する
東京民医連理事会、法人院所は都立病院、近隣医療機関に後発品使用促進を働きかける